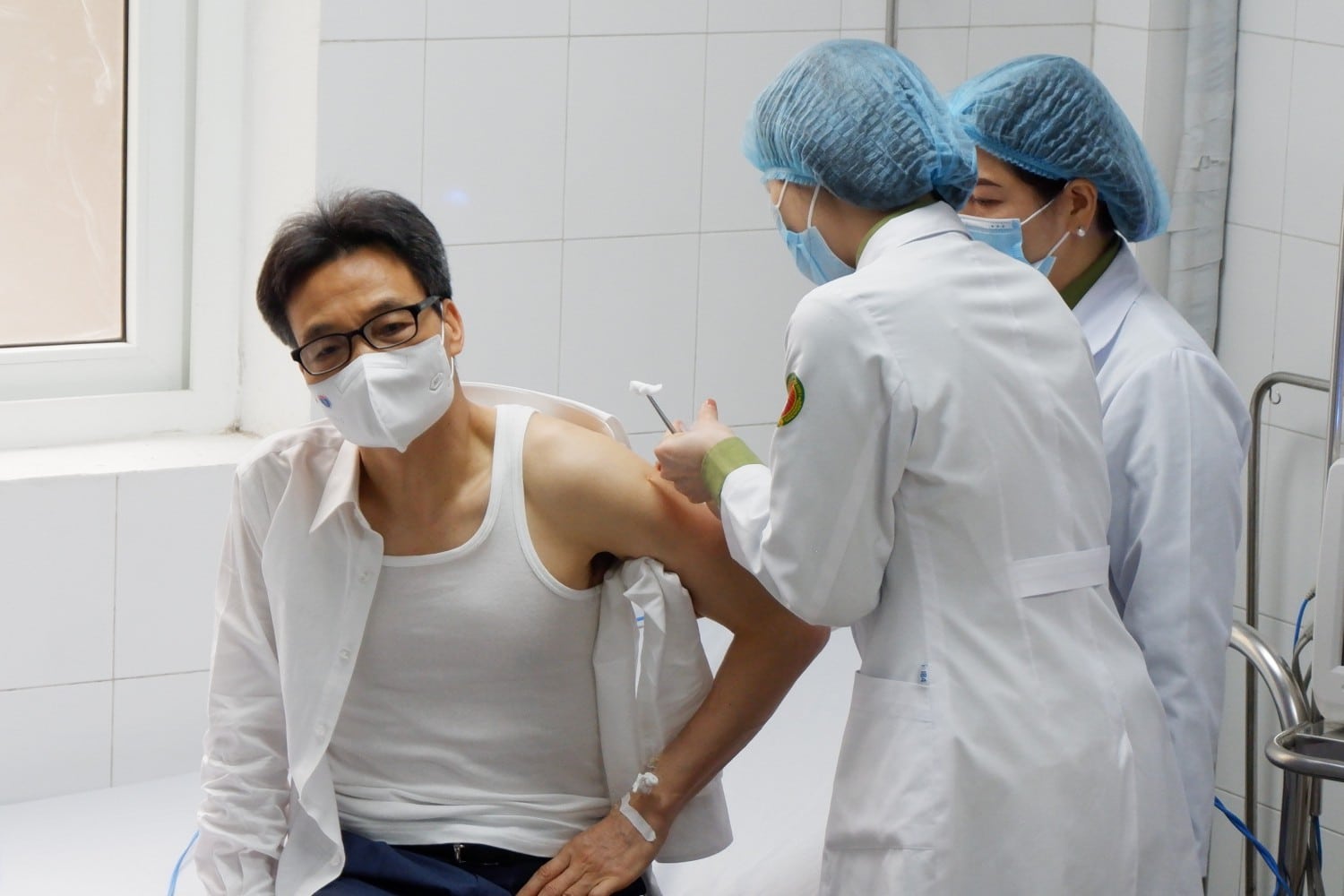
Chiều 27.8, Công ty cổ phần công nghệ Dược Nanogen cho biết Hội đồng Đạo đức trong nghiên cứu y sinh học quốc gia đã chấp thuận kết quả thử nghiệm lâm sàng giữa kỳ pha 3a (giai đoạn thử nghiệm lâm sàng 3a – PV) vaccine Covid-19 Nanocovax.

Tín hiệu vui về vaccine Covid-19 sản xuất tại Việt Nam
Toàn bộ hồ sơ, dữ liệu nghiên cứu của vaccine Nanocovax đã được chuyển sang Hội đồng Tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc để xem xét cấp phép khẩn cấp có điều kiện với vắc xin Nanocovax. Trước đó, Hội đồng Đạo đức đã họp, thẩm định báo cáo giữa kỳ pha 3a vaccine Nanocovax, đánh giá về tính an toàn và sinh miễn dịch.

Tại buổi báo cáo, nhóm nghiên cứu cho biết vaccine Nanocovax đạt yêu cầu về tính an toàn và tính sinh miễn dịch.
Cụ thể, trong giai đoạn 3a, khả năng trung hoà virus sống của vaccine Nanocovax tại thời điểm ngày thứ 42 (tức 14 ngày sau tiêm mũi 2) là 96,5%.
Vaccine Nanocovax hiệu quả với biến chủng Delta đạt khoảng 75%
Gộp chung giai đoạn 2 và 3a, nhóm nghiên cứu kết luận, trung bình nhân nồng độ kháng thể Anti-S-IgG đạt 57.56 U/ml, tăng gấp 218.93 lần sau 42 ngày tiêm vaccine. Tỉ lệ chuyển đổi huyết thanh đạt 99.2%

Hiệu quả bảo vệ của vaccinen Nanocovax có thể tương đương với nhiều vaccine ngừa Covid-19 khác trên thế giới, riêng với biến chủng Delta đạt khoảng 75%.
Về các phản ứng phụ sau tiêm như đau tại vị trí tiêm, mệt mỏi, đau khớp, buồn nôn… chủ yếu ở mức độ nhẹ và trung bình.
Sớm đưa vaccine Nanocovax vào sử dụng
Theo Thông tư 11 Hướng dẫn đăng ký lưu hành vaccine phòng Covid-19 trong trường hợp cấp bách vừa được Bộ Y tế ban hành ngày 19/8, vaccine đủ tiêu chuẩn cấp phép khẩn cấp có điều kiện khi đang thử nghiệm lâm sàng và đã có kết quả giữa kỳ pha 3 về tính an toàn và hiệu quả bảo vệ của vaccine dựa trên dữ liệu về tính sinh miễn dịch.
Việc cấp phép sẽ dựa trên ý kiến tư vấn của Hội đồng đạo đức trong nghiên cứu y sinh học cấp quốc gia và ý kiến tư vấn của Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc, có tham khảo hướng dẫn hoặc khuyến cáo của Tổ chức Y tế thế giới.
Trong thời hạn tối đa 20 ngày làm việc kể từ ngày nhận đủ hồ sơ đối với hồ sơ đề nghị cấp giấy đăng ký lưu hành vaccine, Cục trưởng Cục Quản lý Dược sẽ cấp giấy đăng ký lưu hành vaccine.
Sau khi được cấp phép lưu hành, cơ sở đăng ký phải tiếp tục phối hợp với cơ sở sản xuất thực hiện nghiên cứu lâm sàng và cập nhật dữ liệu lâm sàng theo hướng dẫn của Bộ Y tế.